Rehabilitacja i fizjoterapia po zabiegu laminektomii odcinka lędźwiowego kręgosłupa.

Jedną z częściej stosowanych metod leczenia neurochirurgicznego dolegliwości bólowych kręgosłupa lędźwiowego jest laminektomia. Najczęściej stosowana jest ona w celu złagodzenia dolegliwości bólowych kręgosłupa lędźwiowego spowodowanych stenozą. W większości znanych przypadków pacjenci po zabiegu laminektomii odzyskują sprawność powoli a dolegliwości bólowe mogą utrzymywać się nawet do 18 miesięcy po zabiegu.
W pracy przedstawiono algorytm postępowania fizjoterapeutycznego u pacjentów po zabiegu laminektomii lędźwiowego odcinka kręgosłupa.
Zmiany zwyrodnieniowe w odcinku lędźwiowym kręgosłupa obserwuje się już u osób po dwudziestym roku życia, jednak największe nasilenie osiągają w piątej dekadzie życia. W młodszym wieku przyjmują one najczęściej charakter niemy klinicznie jednak z czasem nieodzownie zaczynają towarzyszą im ból oraz ubytkowe objawy neurologiczne.
Z uwagi na stale zwiększające się średnie przeżycie, liczba osób cierpiących z powodu zmian zwyrodnieniowych będzie stale rosła stawiając coraz większe wyzwania światu fizjoterapii oraz neurochirurgii [1].
Charakter oraz umiejscowienie zmian zwyrodnieniowych stwierdzonych w badaniach radiologicznych oraz neuroradiologicznych nie zawsze korelują ze zmianami neurologicznymi oraz nasileniem dolegliwości pacjenta. Sytuacja taka powoduje iż odnotowane duże zmiany degeneracyjne zarówno krążka międzykręgowego jak i elementów kostnych kręgosłupa mogą dawać skąpe objawy neurologiczne, a w przypadku nieznacznych zmian zwyrodnieniowych powodować uporczywy ból i znaczne ubytkowe objawy neurologiczne [2]. W momencie kiedy leczenie zachowawcze
w postaci fizjoterapii nie przynosi zadowalającego rezultatu podejmowana jest decyzja o leczeniu operacyjnym [3]. Aktualnie przyjmuje się że do leczenia chirurgicznego kwalifikowani są chorzy z dużym bólem 8-10 w skali VAS, ubytkowymi objawami neurologicznymi nieustępującymi po leczeniu zachowawczym obejmującym farmakoterapię oraz fizjoterapię trwającą przez okres co najmniej trzech miesięcy [4].

Aktualnie stosowane są różne techniki operacyjne w zależności od nasilenia zmian klinicznych oraz charakteru obrazu radiologicznego, z nie zawsze zadowalającą skutecznością [5]. Jednym z typów zabiegów o największym charakterze resekcji jest obarczająca laminektomia dająca zadowalające wyniki w 62% do 70% przypadków [6]. Stosowana jest ona w przypadku masywnej dyskopatii centralnej z towarzyszącymi zaawansowanymi zmianami zwyrodnieniowymi, chromaniem neurogennym i stenozą kanału kręgowego. Typowo przebiegająca laminektomia powoduje uwolnienie
z ucisku przeciążonych struktur nerwowych powodując zazwyczaj zmniejszenie objawów neurologicznych. Laminektomia może być operacją samodzielną, lub może być łączona ze stabilizacją kręgosłupa. Stabilizację przeprowadza się, gdy w trakcie operacji istnieje konieczność usunięcia stawów kręgosłupa, celem zabezpieczenia przed dalszym postępem zmian zwyrodnieniowych i w dużych bólach kręgosłupa [7].
W trakcie zabiegu dochodzi wtórnie do naruszenia integralności łuków kręgów objętych zmianami, wyrostków kolczystych, więzadeł żółtych oraz stawów międzywyrostkowych (facetektomia). Powoduje to zaburzenie biomechaniki na danym poziomie zwłaszcza iż uszkodzone zostają również przyczepy mięśni.
Postępowanie po zabiegu do czternastej doby.
Tuż po zabiegu operacyjnym na pierwszy plan wysuwa się leczenie bólu pooperacyjnego, które często prowadzone jest również po wypisaniu pacjenta z oddziału neurochirurgicznego. Fakt farmakologicznej terapii przeciwbólowej jest bardzo istotnym czynnikiem warunkującym przebieg oraz intensywność fizjoterapii, zwłaszcza iż leczenie to prowadzone jest często do kilku miesięcy po zabiegu [1].

Leczenie bólu pooperacyjnego stanowi duże wyzwanie. Ze względu na to, iż jest to subiektywne odczucie dla każdego pacjenta, określenie jego obiektywnej „wartości” jest niemożliwe. Z pomocą przychodzą tu subiektywne skale oceny. Do najczęściej wykorzystywanych zaliczamy skalę:
- wzrokowo-analogową (VAS)
- numeryczną (NRS)
- słowną (VRS)
Niemałe znaczenie w leczeniu bólu pooperacyjnego, jako uzupełnienie fizjoterapii, stanowi podawanie środków farmakologicznych. Światowa Organizacja Zdrowia (WHO) opracowała i zaleca stosowanie tzw. trójstopniowej drabiny analgetycznej. W ten sposób, leki zlecane są w zależności od natężenia dolegliwości bólowych:
I stopień to proste analgetyki –wykorzystywane najczęściej w bólu słabym i umiarkowanym; w tej grupie wyróżniamy między innymi kwas acetylosalicylowy, diklofenak, ibuprofen, paracetamol, metamizol.
II stopień stanowi połączenie powyższych ze słabymi lekami opioidowymi czyli tramadolem, kodeiną, buprenorfiną. Tutaj najczęstszym zastosowaniem są bóle o dużym nasileniu (np. ostry ból pooperacyjny).
III stopień to proste analgetyki łączone z silnymi opioidami –morfiną, oksykodonem i fentanyle
Pamiętać tu należy o podstawowych zasadach takich jak kontrolowanie działania przeciwbólowego, wybieranie minimalnej skutecznej dawki, odstawianie nieskutecznego leku przeciwbólowego, w bólach przewlekłych stosowanie preparatów o przedłużonym działaniu, dokumentacja i przeciwdziałanie objawom niepożądanym każdej z grup leków[8].
Pewną uwagę poświęcić należy również farmakoterapii wspomagającej (tzw. koanalgetyki). Są to leki które same
w sobie nie wykazują bezpośredniego działania przeciwbólowego, natomiast ich działanie pośrednie lub wywierane skutki uboczne wspomagają właściwy lek przeciwbólowy (tzw. terapia multimodalna) [8].
Do najczęściej wykorzystywanych tu preparatów zaliczamy m.in.
Klonidyna – dzięki niej możliwe jest ograniczenie dawek opioidów, jednakże liczne działania niepożądane i konieczność stałego monitorowania ograniczają grupę pacjentów do chorych hospitalizowanych;
Gabapentanoidy -leki stosowane jako przeciwpadaczkowe. W leczeniu przeciwbólowym wykorzystano fakt, iż lek działa w ośrodkowym układzie nerwowym zmniejszając uwalnianie neuroprzekaźników o działaniu pronocyceptywnym;
Neuroleptyki –to leki o działaniu przeciwlękowym i uspokajającym, mogą być łączone z opioidami wykazującwłaściwości przeciwwymiotne;
Ketamina –ten lek wykazuje bezpośrednie działanie przeciwbólowe, może być wykorzystany w przypadku tolerancji na opioidy.
Jeżeli nie doszło do powikłań po operacji zalecane jest pozostanie w łóżku przez okres2 -3 dni, przy czym okres ten u osób w podeszłym wieku może się wydłużyć. W tym okresie wprowadzane jest stopniowe uruchamianie chorego trwające zwykle na oddziale neurochirurgicznym do 7 doby po zabiegu. Celem fizjoterapii pierwszego rzutu jest w pierwszej kolejności usprawnienie układu krążeniowo-oddechowego, działanie przeciwzakrzepowe oraz przygotowanie chorego do samodzielnego poruszania się [8].
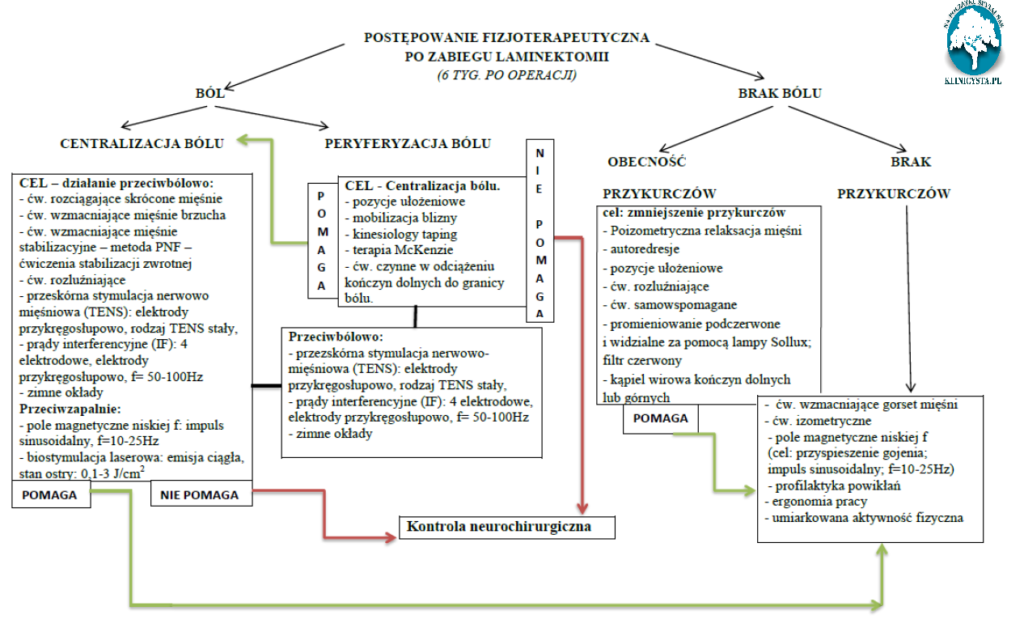
W czternastą dobę po zabiegu podczas wizyty kontrolnej ściągane są zazwyczaj szwy pooperacyjne,a pacjent kierowany jest na oddział stacjonarnej rehabilitacji neurologicznej,którą może rozpocząć z reguły w szóstym tygodniu po zabiegu.
W proponowanym przez nas algorytmie postępowania po szóstym tygodniu po zabiegu za kryterium doboru procedur fizjoterapeutycznych przyjęto poziom nasilenia bólu oraz obecność lub brak zaburzeń funkcji mięśni. O kwalifikacji pacjenta do opisanego w algorytmie postępowania przeciwbólowego decydował poziom bólu 3 lub więcej wg skali VAS. Jeżeli ból był mniejszy pacjent kwalifikowany był automatycznie do drugiej grupy postępowania terapeutycznego.
Program fizjoterapii w przypadku obecności dolegliwości bólowych.
W przypadku występowania dolegliwości bólowych (3 > wg skali VAS) należy zwrócić szczególną uwagę na określenie charakteru zgłaszanych przez pacjenta dolegliwości. Celem postępowania fizjoterapeutycznego w przypadku peryferalizacji objawów jest doprowadzenie do ich centralizacji. W tym celu skupić się należy na określeniu a następnie zastosowaniu odpowiednio dobranych pozycji ułożeniowych zmniejszających bądź centralizujących zgłaszane przez pacjenta dolegliwości [9]Dodatkowo stosować można terapię Mckenzie, której ćwiczenia pacjent powinien wykonywać w określonych przez terapeutę odstępach czasowych. Jako uzupełnienie stosowanej terapii każdy pacjent powinien mieć wykonywaną mobilizację blizny pooperacyjnej, manualnie bądź z wykorzystaniem metody Kinesio Taping (technika więzadłowa), oraz codziennie przez 20 minut ćwiczenia czynne w odciążeniu kończyn dolnych w płaszczyźnie strzałkowej.
W przypadku centralizacji objawów w okolicy L-S należy skupić się w pierwszej kolejności na ćwiczeniach rozciągających mięśnie przykurczone obejmujące grupę kulszowo goleniową oraz okolice mięśni głębokich miednicy. W następnej kolejności stopniowo wprowadza się ćwiczenia mięśni brzucha. Początkowo izometryczne a następnie czynne i czynne z oporem. W tym samym czasie stosuje się ćwiczenia stabilizacji posturalnej oraz dynamicznej z wykorzystaniem metody PNF. Dodatkowo w określonych przez terapeutę odstępach czasowych pacjent ma za zadanie wykonywać ćwiczenia mięśni dna miednicy oraz wielodzielnego lędźwi [9].
W obydwu przypadkach tj. dolegliwości o charakterze peryferycznym oraz centralnym zaleca się stosować codziennie fizykoterapię, która nakierowana jest na działanie przeciwbólowe oraz przeciwzapalne. W tym celu stosuje się przezskórną stymulację nerwowo -mięśniową (TENS) oraz prądy interferencyjne.
W terapii (TENS) u podstaw działania przeciwbólowego leży teoria bramki kontrolnej, inaczej przepustu rdzeniowego Walla i Melzaka. Zakłada ona, że bodźce odbierane przez receptory skórne hamują odczuwanie dolegliwości bólowych. W analizowanym przypadku zaleca się stymulację stałą (HV TENS) z wykorzystaniem prądów wysokiej częstotliwości wgranicach 50-200Hz o czasie trwania impulsu 50-100 mikrosekund. Pacjent początkowo odczuwa charakterystyczne mrowienie, wibrację w dalszej części zabiegu tkanka przyzwyczaja się do bodźca elektrycznego i nie odczuwa już żadnych bodźców, pojawia się uczucie znieczulenia. Zabiegtrwa od 15 min aż do 30 min. [10]
Stymulacja ta działa pobudzająco na szybko przewodzące, grube włókna Aβ, które przewodzą bodźce dotykowe z receptorów skóry. Pojawia się wtedy lawina powiązanych ze sobą reakcji, które następują po sobie. Włókna Aβ aktywują neurony w substancji galaretowatej w rogach tylnych rdzenia kręgowego, następnie dochodzi do zahamowania włókien odpowiedzialnych za przewodzenie bólu z tkanek obwodowych do rogów tylnych rdzenia kręgowego, co powoduje hamowanie przepływu impulsów bólowych do wyższych pięter ośrodkowego układu nerwowego. Mózg gdy odbiera bodźce czuciowe ogranicza przetwarzanie bodźców bólowych z uszkodzonych tkanek [11]. Podczas wykonywania zabiegu elektrody ułożone zostają przykręgosłupowo (gdy schorzenie występuje w obrębie kręgosłupa) lub w punktach maksymalnie bolesnych lub na przebiegu nerwu. Natężenie dostosowywane jest do odczuć pacjenta. Wg wielu badań przeprowadzanych nad skutecznością działania przeciwbólowego prądów TENS, prawie wszystkie jednoznacznie pokazują, że po stosowaniu serii zabiegów dolegliwości bólowe zmniejszają się, nie zawsze są one całkowicie zniesione, ale za każdym razem widać poprawę, która jest równoznaczna z uśmierzeniem bólu w różnym stopniu [12, 13,14,15,16,17]
Efekt działania prądów interferencyjnych –Nemecka –powstaje na skutek nakładania się prądów sinusoidalnie zmiennych średniej częstotliwości. Modulacja powstaje w ciele pacjenta w dwóch niezależnych obwodach elektrycznych. Najczęściej stosuje się stymulację z wykorzystaniem 4 elektrod, które ułożone są przykręgosłupowo (jeżeli dolegliwości dotyczą kręgosłupa). Najlepszy efekt przeciwbólowy można uzyskać przy zastosowaniu częstotliwości 50-100Hz.
Polepsza ona ukrwienie, przyspiesza przemianę materii w obrębie komórki, a dodatkowo ma silne działanie przeciwbólowe. Natężenie dostosowuje się do odczuć pacjenta, ale odczucie to musi być wyraźne, ponad próg odczuwania[18]. Działanie przeciwbólowe wykazane jest w wielu badaniach, lecz wskazują one, że działanie tylko i wyłącznie prądów interferencyjnych nie daje aż tak dobrych efektów jak stosowanie ich w połączeniu w innymi zabiegami fizykoterapeutycznych np. TENS [18,19,20,21,22,23]
Celem zmniejszenia stanu zapalnego tkanek stosuje się pole magnetycznego niskiej częstotliwości z impulsem sinusoidalnym, który działa na tkankę mięśniową. Pole magnetyczne powoduje hiperpolaryzację błony komórkowej, co wpływa na poprawę przemiany materii. Dodatkowo pod wpływem pola magnetycznego dochodzi do normalizacji potencjału spoczynkowego błony komórkowej, a także usprawnia się proces transportu jonów przez błonę komórkową. Efekt biologiczny dotyczy również zwiększenia syntezy ATP, poprawia zużycie tlenu na poziomie komórkowej. Częstotliwość wykorzystywana w magnetoterapii: w stanach ostrych –1-5 Hz, w podostrych 5-20 Hz, a w stanach przewlekłych 20 -50 Hz [4] Działanie przeciwbólowe impulsowego pola magnetycznego niskiej częstotliwości zostało potwierdzone w badaniach prowadzonych przez wielu autorów [24,25,26].
Wszystkie wyżej wymienione oddziaływania powodują działanie przeciwbólowe, przeciwzapalne, zwiększenie regeneracji uszkodzonych tkanek, w tym przyspieszenie resorpcji krwiaków, obrzęków, wysięków oraz poprawę funkcji kolagenu[23].
Działanie przeciwzapalne wspomagać można również biostymulacją laserową. Laser malej mocy wywołuje w tkankach regeneracje, poprawia ukrwienie i odżywienie tkanek. [24,25]. Procesy stymulacyjne związane są głównie z poprawą krążenia, regeneracją komórek oraz poprawą odżywienia tkanek. Działanie przeciwbólowe przede wszystkim opiera się na wzmożonym wytwarzaniu endorfin, hiperpolaryzacją błon komórkowych, a także przyspieszeniu regeneracji obwodowych aksonów w sytuacji gdy zostały uszkodzone nerwy. Natomiast działanie przeciwzapalne wiąże się z poprawą mikrokrążenia, rozszerzeniem naczyń krwionośnych oraz przyspieszeniem resorpcji wysięków. Na minimalizację odczynu zapalnego wpływa również ułatwienie wytworzenia krążenia obocznego, do czego również przyczynia się biostymulacja laserowa [27]W stanie ostrym stosowano moc: 0,1-3 J/cm2, podostrym: 3-6 J/cm2, a w stanie przewlekłym: 6-9 J/cm2.Postępując zgodnie z prawem Arndta-Schultza, które mówi, że tylko bodźce średnie dają działanie terapeutyczne, zaś bodźce zbyt silne mogą powodować odwrotny efekt, wręcz hamując to działanie [28].
Uzupełnieniem fizykoterapii są zabiegi z wykorzystaniem promieni podczerwonych i widzialnych za pomocą lampy Sollux. Ich działanie wynika głównie z reakcji tkanek na bodźce cieplne. Wśród nich wyróżnia się rozszerzenie naczyń krwionośnych, reakcja ze strony naczyń głębiej położonych, zgodna z prawem Daestre -Morata, podwyższenie progu bólu, wzrost przemiany materii. Odczyn w tkankach zgodnie z prawem Grotthusa -Drapera powodują tylko i wyłącznie promienie pochłonięte przez tkanki. W leczeniu stanów zapalnych stosuje się filtr koloru czerwonego. Stosuje się go ponadto w bólach mięśniowych, gdzie zmniejsza napięcie mięśniowe, poprzez działanie rozgrzewające[31].
Według autorów [9] główną przyczyną występowania dolegliwości bólowych w okresie powyżej sześciu miesięcy od zabiegu jest brak balansu oraz wytrzymałości mięśni niezbędnej w stabilizacji odcinka lędźwiowo-krzyżowego w statyce oraz podczas zadań dynamicznych. Dużą rolę w tym procesie odgrywają mięśnie stabilizujące czynnie staw krzyżowo-biodrowy, który odgrywa zasadniczą rolę w transferze sił między kończynami dolnymi a tułowiem. Jak wynika z naszych obserwacji u większości pacjentów występuje dodatni test ASLR zwłaszcza w pozycji leżenia przodem dla ryglowania siłowego stawów krzyżowo-biodrowych. Dodatkowo u części osób (zwłaszcza po 50 roku życia) występuje również dodatni test ASLR dla ryglowania strukturalnego, związany najprawdopodobniej z występowaniem dużych zmian zwyrodnieniowych w obrębie stawów krzyżowo-biodrowych.W toku prowadzonej fizjoterapii w przypadku poprawy manifestującej się zmniejszeniem bólu w skali VAS oraz/lub zmniejszeniem objawów korzeniowych należy włączyć ćwiczenia wzmacniające gorset mięśniowy oraz poprawiające ergonomię pracy dobranej indywidualnie do potrzeb każdego pacjenta. W przypadku natomiast braku poprawy manifestującej się zwiększeniem bólu w skali VAS lub/i nasileniem objawów korzeniowych wymagana jest konsultacja neurochirurgiczna[9].
Program fizjoterapii w przypadku braku obecności dolegliwości bólowych.
Wśród osób u których ból wynosi 2 lub mniej w skali VAS należy zastosować terapię celowaną w przywrócenie prawidłowej funkcji mięśni.W momencie gdy nie ma dolegliwości bólowych, a pojawiają się przykurcze mięśniowe należy skupić się na przeciwdziałaniu im. Można zastosować zabiegi z zakresu termoterapii na przykurczone struktury. Wykorzystywane jest m.in. światło podczerwone i widzialne w użyciem filtra czerwonego.
Powoduje ono silnie przegrzanie i przekrwienie tkanek, rozszerzenie naczyń krwionośnych, co prowadzi do zmniejszenia napięcia tkanek miękkich. Kąpiele wirowe kończyn dolnych prowadzą do poprawy krążenia w kończynach, a ciepła woda używana podczas takiej kąpieli ma działanie takie samo jak wszystkie zabiegi w użyciem ciepła [24,25]. Do terapii przykurczy stosuje się metodę poizometrycznej relaksacji mięśni, autoredresji czy ćwiczeń samowspomaganych. W walce w przykurczonymi tkankami miękkimi pomocne są pozycje ułożeniowe, które należy zakwalifikować jako rodzaj autoredresji, ponieważ przy użyciu siły ciężkości i ciężaru własnego ciała można rozciągnąć zaburzone struktury [10].
W sytuacji kiedy brak jest dolegliwości bólowych a testy oceniające długość mięśni obręczy biodrowej oraz tułowia są ujemne, celem terapii staje się wzmocnienie gorsetu mięśniowego oraz poprawa funkcji mięśni. Według autorów sytuacja taka wbrew pozorom stanowi duże wyzwanie terapeutyczne, ponieważ część pacjentów brak dolegliwości bólowych traktuje jako oznakę wyleczenia starając się jak najszybciej powrócić do codziennego trybu życia. Działania takie skutkują w krótkim okresie czasu powrotem dolegliwości bólowych lub wręcz ich nasileniem. Zdarzają się sytuacje, kiedy wręcz wymagana staje się ponowna interwencja neurochirurgiczna. Kluczowym staje się w tym momencie uzmysłowienie chorym celowości dalszej terapii pod okiem specjalisty oraz konieczności przestrzegania zasad ergonomii pracy po powrocie do domu. Ważne jest aby brak dolegliwości pooperacyjnych nie powodował zbyt wczesnego powrotu do pracy czy nadmiernej aktywności fizycznej, która powinna być stopniowo dozowana[1].
Na pierwszy plan terapii wysuwają się w tym przypadku treningi poprawiające balans oraz wytrzymałość mięśniową, oraz trening wewnętrznych stabilizatowów odcinka lędźwiowego, w szczególności: mięśnia wielodzielnego oraz poprzecznego brzucha[7].
Reasumując, można zauważyć ciągle zwiększającą się ilość hospitalizacji na oddziałach rehabilitacji neurologicznych pacjentów po zabiegach neurochirurgicznych w odcinku lędźwiowym kręgosłupa z powodu ostrych dolegliwości bólowych z towarzyszącymi neurologicznymi objawami ubytkowymi. Jak wynika z naszego doświadczenia oraz subiektywnej opinii stan taki związany jest w większości ze zbyt późnym wdrożeniem procesu fizjoterapii u chorych. Przyczyniać może się do tego zbyt mała świadomość zainteresowanych odnoście możliwości wcześnie wprowadzonej fizjoterapii, przeceniania leczenia farmakologicznego (głównie przeciwbólowego) jak również zbyt szybka interwencja chirurgiczna.
Dodatkowo zbyt szeroko wykonana laminektomia z facetektomią może po kilku miesiącach lub latach prowadzić do wtórnej hipermobilności kręgosłupa pod postacią podwichnięć rotacyjnych, kręgozmyków czy tyłozmyków[1].
Piśmiennictwo.
1. Herkowitz H., Degenerative lumbar spondylolisthesis: evolution of surgical management. The Spine Journal. 9(7),605-606, 2009.
2. Turner J.A., Ersek M., Herron L., Deyo R.: Surgery for lumbar spinal stenosis. Attempted meta-analysis of the literature. Spine 1992, 17, 1-8.
3. Ciol M.A., Deyo R.A., Howell E., Kreif S.: An assessment of surgery for spinal stenosis: time trends, geographic Variations, complications, and reoperations. J. Am. Geriatr. Soc. 1996,44,285-29.
4. Postacchini F.: Spine update. Surgical management of lumbar spinal stenosis. Spine1999, 24,1043-104.
5. Katz J.N., Lipson S.J., Lew R.A., Groblerl J., Weinstein J.N., Brick G.W., Fossel A.H., Liang M. H.: Lumbar laminectomy alone or with instrumented or noninstrumented arthrodesis in degenerative lumbar spinal stenosia. Patients selection, costs, and surgical outcomes. Spine 1997, 22, 1123-113.
6. Tsai R.Y., Yang R.S., Bray S.R. Jr: Microscopic laminotomies for degenerative lumbar spinal stenosis. J. Spinal Disord. Tech. 1998, 11, 389-39.
7. Richter A, Kotsombelis S at all., Comparison between Laminectomyand Interspinous Devices for Treatment of Lumbar Spinal Stenosis. The Spine Jurnal. 14(11), ,2014 53.
8. Bromley L, Brander B. Ból ostry. Warszawa 2013, wyd 1. 38-72.
9. Chiropractic Management of Postsurgical Lumbalr Spine Pain. A retrospective study of32 Cases. Journal of Manipulative and Physiological Therapeutic. 36(6),408-412, 2011.
10. Kuciel-Lewandowska J., Jarosz N., Ocena skuteczności terapii prądami TENS i Traberta u chorych z bólem dolnego odcinka kręgosłupa, Acta Balneologica, 2010.
11. Pyszora A., Kujawa J., Zastosowanie elektroterapii w leczeniu bólu, Polska Medycyna Paliatywna 2003, 2, 3, 167-173.
12. Transcutaneous electrical nerve stimulation: Basic science mechanisms and clinical effectiveness, Sluka K., Journal of pain 2003.
13. Transcutaneous electrical nerve stimulation for the treatment of chronic low back pain: a systematic review, Khadilkar A., Milne S., Brosseau L., Wells G., Tugwell P., Robinson V., Shea B., Saginur M., Spine 2005, 1, 30.
14. Efficacy of electrical nerve stimulation for chronic musculoskeletal pain: A meta-analysis of randomized controlled trials, Johnson M., Martinson M., Pain 2007,
15. Ainsworth L, Budelier K, Clinesmith M, et al. Transcutaneous electrical nerve stimulation (TENS) reduces chronic hyperalgesia induced bymuscle inflammation, Pain 2006.
16. Ratajczak B, Hawrylak A, Demidaś A, Kuciel-Lewandowska J, Boerner E. Effectiveness of diadynamic currents and transcutaneous electrical nerve stimulation in disc disease lumbar part of spine. J Back Musculoskelet Rehabil. 2011, 24,3, str.155-159.
17. Shokrzadeh A., Therapeutic Results of Transcutaneous Electrical Nerve Stimulation in Post Laminectomy Syndrome, Global Journal of Health Science, 2010,2,2.
18. Fuentes J.P., Armijo-Olivo S., Magee D.J., Gross D.P., Effectiveness of Interferential Current Therapy in the Management of Musculoskeletal Pain: A Systematic Review and Meta-Analysis,Physical Therapy, 2010,9.
19. Zambito A., Bianchini D., Gatti D., Rossini M.Adami S., Viapiana O., Interferentail and horizontal therapy in chronic back pain due to multiple vertebral fractures: a randomized, double blind, clinical study, Osteoporos Int 2007.
20. Adedoyin R., Olaogun M.O., Onipede T.O., Ikem I.C., Egwu W.O., Bisiriyu A.,Effects of different swing patterns of interferential currents on patients with low back pain: a single control trial,Fizyoterapi Rehabilitasyon 2005,16,2.
21. Hurley D.A., A Randomized Clinical Trial of Manipulative Therapy and Interferential Therapy for Acute Low BackPain, Spine 2004.
22. Hurley D.A. Minder P.M,, McDonough S.M., Walsh D.M., Moore A.P., Baxter D.G.,Interferential Therapy Electrode Placement Technique in Acute Low Back Pain: A Preliminary Investigation,Arch Phys Med Rehabil. 2001.
23. Johnson M., TabasamG.,An Investigation Into the Analgesic Effects of Interferential Currents and Transcutaneous Electrical Nerve Stimulation on Experimentally Induced Ischemic Pain in Otherwise Pain-Free Volunteers,Physical Therapy, 2003.
24. Shupak NM, McKay JC, Nielson WR, Rollman GB, Prato FS, Thomas AW. Exposure to a specific low frequency magnetic field: A double-blind placebo-controlled study of effects on acute pain ratings in rheumatoid arthritis and fibromyalgia pain populations, Pain Research and Management, 2006, 11, 2.
25. Shupak N.W., Prato F.S., Thomas A.W., Human exposure to a specific pulsed magnetic field: effects on thermal sensory and pain thresholds, Neurosci Lett 2004, 10.
26. Thomas A.W., Graham K., Prato F., McKay J.,Morley Forster P., Moulin D., Chari S.A randomized,double-blind, placebo-controlled clinical trial using a low-frequency magnetic field in the treatment of musculoskeletal chronic pain, Pain Research and Management 2007,12,4.
27. Cenian A., Zaremba E., Frankowski M., Lasery w medycynie, Biostymulacyjne oddziaływanie promieniowania laserowego.
28. Bugajski M., Krukowska J. Czernicki J., Biostymulacyjne promieniowanie laserowe i możliwości jego zastosowania w fizjoterapii, Przegląd Medyczny Uniwersytetu rzeszowskiego i Narodowego Instytutu Leków w Warszawie, Rzeszów2010,3, 343-348.
Powyższy artykuł stanowi część publikacji pt Algorytm postępowania fizjoterapeutycznego u pacjentów po zabiegu laminektomii odcinka lędźwiowego kręgosłupa opublikowanego na łamach czasopisma Journal of Health Sciences. Praca w całości wraz z literaturą dostępna na stronie wydawcy.
Autor dr Michał Cichosz

